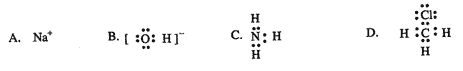绥宁一中高一年级期中考试化学试题 来源:绥宁一中校园网 作者:杨长伟 更新时间:2012-4-13 阅读:38173次 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
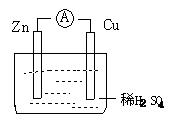
命题人:秦启发 可能用到的相对原子质量: H 1 He 4 N 14 O 16 Na 23 Mg 24 Al 27 Cl 35.5 Br 80 Fe 56 Ag 108 一、选择题(本题包括10小题,每小题3分,共60分。每小题只有一个选项符合题意。) 1.与OH-具有相同质子数和电子数的粒子是:( ) A.F- B.Cl- C.NH3 D.NH 2.氢氧化钠与盐酸的反应属于( )。 A.吸热反应 B.放热反应 C.既是吸热反应也是放热反应 D.都不是 3.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的 A. B. C. D. 4.列说法中错误的是( ) A.化学反应中的能量变化通常表现为热量的变化 B.化学键的断裂和形成是化学反应中能量变化的主要原因 C.需要加热才能发生的反应一定是吸热反应 D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 5. 下列情况不造成环境污染的是( )。 A.燃烧液化石油气 B.燃烧管道煤气 C.燃烧氢气 D.燃烧木材 6.决定化学反应速率的主要因素是:( ) A.催化剂 B.参加反应的物质的性质 C.温度 D.压强 7.元素的性质随着原子序数的递增呈现周期性变化的根本原因是:( ) A.元素相对原子质量的递增而引起的变化 B.元素的化合价呈周期性的变化 C.元素原子核外电子排布呈周期性的变化 D.元素的金属性和非金属性呈周期性变化 8.如图所示的原电池装置,下列说法不正确的是:( ) A.该装置的能量转化形式为:化学能转化为电能 B.电子由Zn片经过导线流向铜片 C.Zn为负极发生还原反应 D.Cu为正极,在Cu片上有气泡产生 9.已知反应X+Y=M+N为放热反应,对该反应的说法正确的是:( ) A.X的能量一定高于M B.X和Y的总能量一定高于M和N的总能量 C.X和Y的总能量一定低于M和N的总能量 D.因为该反应为放热反应,故不必加热就能发生 10.100ml 1mol/L的盐酸跟过量锌片反应,为加快反应速率。又不影响生成氢气的总量,可采用的方法是:( ) A.加入适量的2mol/L的盐酸 B.加入数滴CuSO4溶液 C.加入适量的蒸馏水 D.将反应装置放入冰水中冷却 11.A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( ) A.A>B>C B.A>C>B C.B>A>C D.B>C>A 12.在一个密闭容器中,盛有N2和H2,发生反应N2+3H2==2NH3 ,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内用NH3 表示的平均反应速率是( ) A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1 C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1 13.下列装置中能构成原电池的是( )
14.下列变化中不需要破坏化学键的是( ) A.加热氯化铵 B.干冰气化 C.NaHSO4熔化 D.溴化氢溶于水 15.下列各组中前者与后者的关系正确的是:( ) A. 酸性:HClO4>H2SO4 B.稳定性: HBr>HCl C. 半径: Cl >S D碱性: NaOH>KOH 16.下列说法正确的是( ) A.化学键的断裂过程中放出热量 B.化学键形成的过程需要吸收热量 C.原电池的正极发生氧化反应 D.原电池的负极发生氧化反应 17.某元素X最高价含氧酸的化学式为H2XO4,则在其气态氢化物中X元素的化合价为( ) A.-2 B.-3 C.-4 D.-1 18.下列电子式错误的是( )
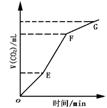
19.把下列四种X溶液分别加入四个盛有10mL 2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓缓地进行反应.其中反应速率最大的是( ) A.10mL3mol·L-1的X溶液 B.10mL2mol·L-1的X溶液 C.10mL4mol·L-1的X溶液 D.10mL2mol·L-1的X溶液 20.用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示.根据分析、判断,正确的是( ) A.OE段表示反应速率最快 B.EF段表示反应速率最快,收集的CO2最多 C.FG段表示收集的CO2最多 D.OG段表示随着时间的推移,反应速率逐渐增快
二、填空题(每空2分,共28分) 21.下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
(1)写出下列元素的元素符号:① ⑧ (2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 。 (3)在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是 22.下列各项分别与哪个影响化学反应速率的因素的关系最为密切? (1)硫在氧气中比在空气中燃烧剧烈______________ (2) MnO2加入双氧水中反应更剧烈______________ (3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完____________ (4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生____________ 23.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1molA的单质和足量盐酸反应可置换出11.2L(标准状况下)氢气,这时A转化成与氖原子具有相同电子层结构的离子。试回答: ⑴A是 元素,C是 元素。(用化学式表示) ⑵写出B的最高价氧化物对应的水化物和C的气态氢化物的水溶液反应的离子方程式: 。 ⑶画出A单质的原子结构示意图:__________ 三.实验题(6分)。 24.利用下列反应:Fe + 2Fe3+ = 3 Fe2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,写出电极反应式。
四、计算题(6分) 26.某原子AZX,它的氯化物XCl 5.85g溶于水制成溶液后,加入2mol/L的AgNO3溶液50mol恰好完全反应.若这种原子原子核内有12个中子,求: (1) Z值和A值; (2) X元素在周期表中的位置; (3) 把X的单质放入水中,写出反应的化学方程式. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
联系电话:0739-7611972 湘ICP备14001922号-1 地址:湖南省绥宁县长铺镇工业街10号 湘教QS7_201311_001667