|
复习提问: 1. 1mol物质含有的粒子数约是多少?
2. 什么叫摩尔质量?
引入新课:前面我们学习的物质的量,它把宏观上可称量的物质与微观粒子联系起来,宏观上可感知的除了物质的质量,还有物质所占的体积上节课我们研究了1mol物质所具有的质量,这节课我们来讨论1mol物质所占的体积。
计算标准状况下,1mol H2、O2、CO2气体的体积,并填表:
|
气体 |
粒子数 |
1mol物质质量(g) |
密度(g/L) |
体积(L) |
|
H2 |
6.02×1023 |
2.016 |
0.0899 |
|
|
O2 |
6.02×1023 |
32.00 |
1.429 |
|
|
CO2 |
6.02×1023 |
44.01 |
1.977 |
|
说明:标准状况:0℃,101kPa
讲解:在标准状况下,1mol任何气体所占的体积都约是22.4L。在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子(分子或原子)。所以,单位物质的量的任何气体在相同条件下占有相同的体积,这个体积称为气体摩尔体积。
二、气体摩尔体积
定义:单位物质的量的任何气体在相同条件下占有相同的体积称为气体摩尔体积。
符号:Vm 。 常用单位:L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
取值:标准状况下,Vm=22.4 L/mol ;
25℃和101 kPa(常温常压)时,Vm=24.8 L/mol 。
讨论:气体体积与温度压强有什么关系?
投影练习:
填写下表
|
  物理量 物理量
物质 |
物质的量mol |
体积(标准状况) L |
分子数 |
质量g |
密度g.L-1 |
|
H2 |
0.5 |
|
|
|
|
|
O2 |
|
44.8 |
|
|
|
|
CO2 |
|
|
3.01×1024 |
|
44/22.4 |
|
N2 |
|
|
|
28 |
|
|
Cl2、HCl
混合气 |
|
|
3.01×1023 |

|

|
讨论推导:
物质的量(n)、气体体积(V)气体摩尔体积(Vm)三者的关系:n=V/Vm
小结:物质的量(n)与粒子数目(N)、物质质量(m)、气体体积(V)之间的关系为:
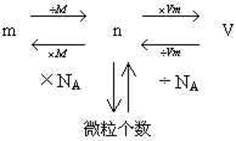
三、物质的量在化学实验中的应用
引言:在化学实验中我们经常要用到溶液
提问:我们学过用什么物理量来表示溶液的组成?
质量分数
过度:在使用溶质的质量分数时有不便之处。例如:在科学实验和工农业生产中,人们在使用溶液时,一般都量取溶液的体积,而较少去称量其质量。此外物质在发生化学反应时,反应物的物质的量之间有一定的比例关系,比质量关系要简单多了。所以有必要学习另外一种表示浓度的方法。是用溶液的体积和物质的量表示的。下面我们来学习这种表示溶液组成的物理量――物质的量浓度。
1. 物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示的溶液组成的物理量,叫做溶质B的物质的量浓度。
用符号cB表示,单位mol/L(或mol·L-1) 表达式: cB=nB/V
|
