|
复习气体摩尔体积、物质的量浓度概念
投影练习:
1).用40 g NaOH配成2 L溶液,其物质的量浓度________mol/L
2).58.5 gNaCl配成500 mL溶液,其物质的量浓度________mol/L
3).标准状况下,22.4 L HCl配成0.5 L盐酸,其物质的量浓度________mol/L
4).物质的量浓度为2 mol/L的硫酸溶液250 mL,含硫酸的物质的量为__________mol
过度:物质的量浓度是表示溶液浓度的一种重要的方法,在学习了概念之后,今天我们学习如何配制一定物质的量浓度溶液的方法。
2. 物质的量浓度溶液的配制
例:计算配制200 mL 0.5 mol/L NaCl溶液需要NaCl的质量是多少?
学生完成,相互纠错。
(NaCl)=n(NaCl)×M(NaCl)=c(NaCl) ×V(NaCl)
=0.5 mol/L× 0.2 L× 58.5 g/mol ≈5.9 g
讲解:用托盘天平称量5.9 g NaCl.
复习托盘天平的使用。
配制用的主要仪器——容量瓶,让学生观察容量瓶,注意有容量、温度和刻度线。介绍其规格,如何检验是否漏水及其使用方法。
分析配制溶液的步骤并投影:
计算、称量、溶解、恢复室温、转移、洗涤、定容、摇匀、装瓶。
完成实验,配制200 mL 0.5 mol/L NaCl溶液。
讨论分析误差。
思考与交流:如果将5 mL 浓硫酸稀释为20 mL 的稀硫酸,得到的稀硫酸与原浓硫酸中所含H2SO4的物质的量相等吗?能说明理由吗?
学生讨论结果:相等。因为稀释时加水,而没有改变H2SO4的量,所以相等。
由此得到稀释公式,即:
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
投影练习:
1.配制250 mL 1 mol/L HCl溶液,需要12 mol/L HCl溶液的体积是多少?
2.将10 mL 2 mol/L的硫酸溶液加水稀释到0.5 mol/L,其体积为多少mL?
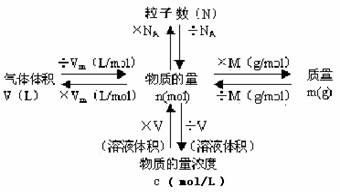
讨论归纳以物质的量为核心的换算关系。
师生共同完成以物质的量为核心的换算关系:
|









