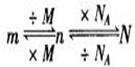|
一、物质的量的单位——摩尔
1.物质的量的单位——摩尔
讲个小故事:曹冲称象,隐含着化整为零的思想;称一个原子的质量,隐含着积少成多的思想。
提问:方程式S+O2===SO2 的含义是什么?
导入:32克硫到底含有多少个硫原子呢?而100个硫原子的质量又是多少呢?
看来需要引入一个新的物理量把宏观可称量的物质和微观粒子联系起来。提到物理量同学们不会感到陌生。你们学习过的物理量有哪些呢?
投影:国际单位制的7个基本单位
|
物理量 |
单位名称 |
单位符号 |
|
长度 |
米 |
m |
|
质量 |
千克 |
kg |
|
时间 |
秒 |
s |
|
电流 |
安[培] |
A |
|
热力学温度 |
开[尔文] |
K |
|
物质的量 |
摩尔 |
mol |
|
发光强度 |
坎[德拉] |
cd |
讲述:在定量地研究物质及其变化时,很需要把微粒(微观)跟可称量的物质(宏观)联系起来。怎样建立这个联系呢?科学上用“物质的量”这个物理量来描述。物质的量广泛应用于科学研究、工农业生产等方面,特别是在中学化学里,有关物质的量的计算是化学计算的核心和基础。这同初中化学计算以质量为基础不同,是认知水平提高的表现。在今后的学习中,同学们应注意这一变化
|
|
H2O |
Al |
C |
|
一个分子或原子的质量 |
2.990×10-23g |
4.485 ×10-23g |
1.993×10-23g |
|
相对分子(或原子)质量 |
18 |
27 |
12 |
|
所含粒子数 |
|
|
|
计算结果表明,18克水或27克铝都约含有6.02×1023个粒子。
展示18克水及27克铝图片及实物样品。
讲下国际象棋和赏麦粒的故事。
结论:
摩尔是物质的量的单位,含有6.02×1023个粒子的任何粒子集体计量为1摩尔。摩尔简称摩,符号 mol。
6.02×1023 mol-1叫做阿伏加德罗常数,是个物理量,符号为NA.
展示1mol的几种物质图片及实物样品。
投影课堂练习:
填空
(1)1 mol O中约含有___________个O;
(2)3 mol H2SO4中约含有__________个H2SO4,可电离出_________mol H+
(3)4 mol O2含有____________mol O原子,___________mol质子
(4)10 mol Na+中约含有___________个Na+
讨论:通过上述练习同学们可以自己总结出物质的量、微粒个数和阿伏加德罗常数三者之间的关系。
物质的量(n)微粒个数(N)和阿伏加德罗常数(NA)三者之间的关系:n=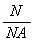
由此可见,采用“mol”来计量巨大数目的粒子非常方便。如:
1 mol H2O 的质量是18 g ,含有6.02×1023个水分子;
2 mol H2O 的质量是36 g,含有1.204×1024个水分子;
1 mol Al 的质量是27 g ,含有6.02×1023个铝原子;
0.5 mol Al 的质量是13.5 g ,含有3.01×1023个铝原子。
思考:1 mol 的任何粒子集体中都含有6.02×1023个粒子;而1 mol 的任何粒子的质量是多少呢?如1 mol O2 质量?1 mol H2 质量?
同学回答:1 mol O2 质量可能是32 g; 1 mol H2 质量可能是2 g。
对!所以得出结论:1 mol 的任何粒子的质量以克为单位,在数值上都等于该粒子的相对原子质量或相对分子质量。由此我们有了另一个概念——摩尔质量
2.摩尔质量
定义:单位物质的量的物质所具有的质量叫做摩尔质量。
符号为M,常用单位为g/mol(或g·mol-1)
练习:填写下列空白:
(1)1 mol Cu原子质量是 克
(2)0.5 mol H2SO4分子质量是 克
(3)2 mol CO2分子质量是 克
(4)3 mol OH-离子质量是 克
(5)0.2 mol Na+离子质量是 克
(6)0.1 mol NaCl质量是 克
由此得出计算式;物质的量(n)、质量(m)和摩尔质量(M)之间的关系为:n=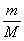
小结:物质质量(m)、物质的量(n)和粒子数(N)之间的关系:
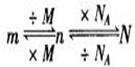 |